Verdens første galvaniske celle ble utviklet av Luigi Galvani. Les om historien. i denne artikkelenI hovedsak er det en midlertidig kilde til elektrisk strøm generert av en kjemisk reaksjon. Strømmen av elektroner genereres av samspillet mellom to forskjellige metaller. Som et resultat omdannes kjemisk energi til elektrisk energi, som deretter kan brukes i hverdagen.
En konsentrasjonsgalvanisk celle er en strømkilde som består av to identiske metallelektroder plassert i en blanding av salter av dette metallet i forskjellige konsentrasjoner.
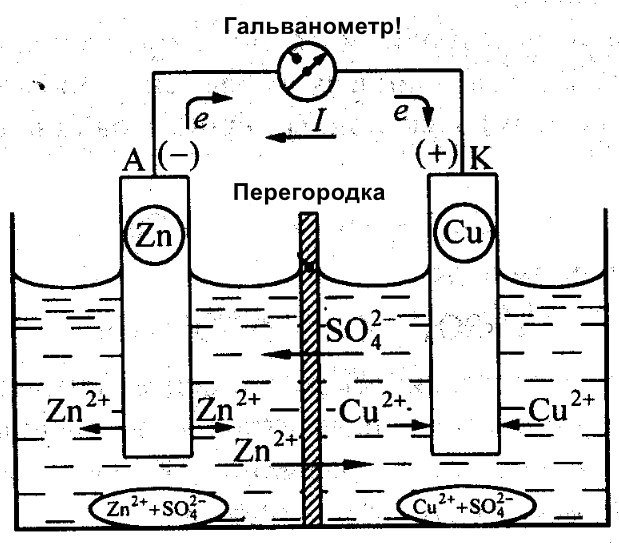
Foruten Galvani jobbet Daniel Jacobi også med å lage et effektivt batteri. Han modifiserte energikilden sin noe. Den består av en kobberplate plassert i CuSO4 og en sinkplate nedsenket i ZnSO4. For å forhindre at de samhandler direkte, er det plassert en porøs vegg mellom dem. Nedenfor er et diagram av Daniel Jacobis galvaniske celle.
Sink og kobber har ulik reaktivitet, og derfor vil ladningen deres variere. Som et resultat er elektrodenivåene heller ikke ensartede. Dette lar dem bevege seg og generere en elektrisk eller galvanisk strøm. Denne strømmen begynner å flyte når en person eller oppfinneren av en strømlagringsenhet kobler til en last. Denne lasten kan være en lyspære, en radio, en datamus eller andre elektriske enheter.
Skjematisk diagram av en galvanisk celle
Et kretsskjema refererer til dets sammensetning og struktur. Det kan konstrueres av flere kjemiske elementer ved hjelp av hjelpeinnretninger. Nedenfor vil strukturen til en galvanisk celle kort beskrives. Les mer om det i denne artikkelen.!
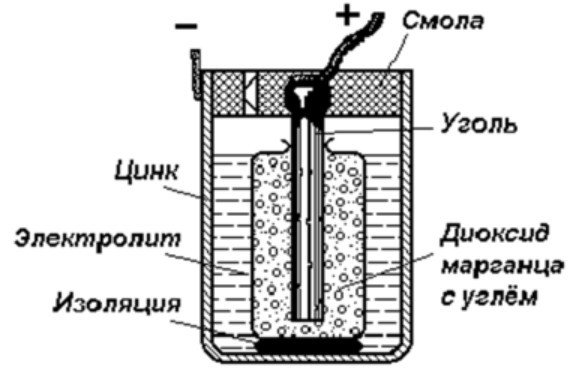
Strukturen til en galvanisk celle
Den enkleste energilagringsenheten består av:
- Kullstang.
- To forskjellige metaller.
- Elektrolytt.
- Harpiks eller plast.
- Isolator.
Som det fremgår av dette diagrammet, består en galvanisk celle av en negativ og en positiv elektrode. De kan være laget av kobber, sink eller andre metaller. De kalles kobber-sinkceller. De kalles noen ganger tørre batterier.
Betegnelse på en galvanisk celle i et diagram Den er laget i form av to vertikale linjer, tett inntil hverandre med liten avstand. En av dem vil være mindre. Ved kantene av hver slik linje er det skilt som indikerer polaritetDen lange linjen er merket positiv, og den korte linjen negativ. Spenningen kan vises ved siden av. Dette betyr at kretsen som bruker batteriet bare fungerer ved den spenningen.
Virkemåten til en galvanisk celle
En galvanisk celle fungerer gjennom bevegelse av elektroner fra en metallkontakt til en annen. En kjemisk transformasjon skjer. Les mer om termodynamikken til en galvanisk celle og dannelsen av galvanisk elektrisitet. Her.
Svar på ofte stilte spørsmål
| Galvanisk | Forklaring |
| Batteri | En energikilde som opererer gjennom prosesser som skjer i et begrenset, miniatyrisert rom. Mer spesifikt genereres energi gjennom en kjemisk reaksjon. |
| Voltaisk celle eller voltaisk haug | Dette er et energielement som først ble opprettet av en forsker ved navn Volt. |
| Behandle | Vekselvirkningen mellom kjemiske elementer som fører til dannelsen av en elektrisk strøm. |
| Utslipp | Dette er fullføringen av en kjemisk reaksjon. Det vil si at det ikke vil være noen interaksjon mellom stoffene. Galvanisk utladning finnes i Warframe. I hovedsak er det en modifikasjon det er mangel på. Den brukes til nærkampvåpen. PolaritetV2. |
| Galvanisk kontakt | Dette er kontakten mellom elektrodene og løsningen. |
| Effekt | Forskjellen mellom to kontakter laget av to typer metall. Størrelsen avhenger av temperaturen og kjemien til lederne. Dette er i hovedsak Voltas første lov. |
| Forbindelse/ledd/kjede | Koble to eller flere deler av en elektrisk krets til en strømkilde. |
| Galvanisk ladning | Fylle batteriet med energi. |
Galvanisering er en kjemisk prosess som bruker elektrisk strøm. Reaksjonen reduserer mengden oppløste metallkationer i en slik grad at de til slutt danner et jevnt belegg på en metallelektrode. Som et resultat blir gjenstanden mer slitesterk, små bulker forsvinner, og utseendet blir mer attraktivt.
Typer galvaniske celler
Det finnes en rekke spesifikke typer batterier.
Tabell over galvaniske celler
| Type | Spenning | Hovedfordeler |
| Litium | 3 V | Stor kapasitet, høy strøm. |
| Saltbatterier eller karbon-sink | 1,5 tommer | Den billigste. |
| Nikkeloksyhydroksyl NiOOH | 1,6 volt | Høy strøm. Høy kapasitet. |
| Alkalisk eller alkalisk | 1,6 V | Høy strøm. Godt volum. |
Dette emnet er dekket mer detaljert i artikkelen. typer batterier!
Formålet med en galvanisk celle
Den er konstruert for å starte elektrisk utstyr. Disse kan omfatte:
- Klokke.
- Fjernkontroller.
- Lommelykter.
- Medisinsk utstyr.
- Bærbare datamaskiner.
- Leker.
- Nøkkelringer.
- Telefoner.
- Laserpekere.
- Kalkulatorer.
Og lignende ting rundt oss.
Galvanisk celle hjemme
Du kan lage en enkel strømkilde selv. For å gjøre dette trenger du følgende forsyninger:
- Plastkopp.
- Elektrolytt. Dette kan være en saltløsning, brus eller sitronsyre fortynnet i vann.
- Plater av to forskjellige metaller. For eksempel aluminium og kobber.
- Ledninger
Produksjonsprosess
Ta en plastkopp og hell elektrolytten i den. Ikke fyll den til randen; det er best å la den være 1-2 centimeter kort. Fest ledningene til metallplatene. Plasser deretter kobber- og aluminiumsplatene på kantene av beholderen. De skal være parallelle med hverandre. Når alt er klart, kan du måle spenningen med et voltmeter.
Koble til enheten og berør probene til kontaktene på strømkilden vår. Hold dem på plass til displayet viser spenning. Vanligvis er det 0,5–0,7 volt. Disse verdiene avhenger av elektrolytten, eller mer presist, stoffet som brukes som elektrolytt.
Slik lages en hjemmelaget galvanisk celle.